Atom Altı Tanecikler
Bir atom, çekirdek ve çekirdeği saran elektron bulutundan oluşmaktadır. Atomun çekirdeğinde nükleon (pozitif yüklü proton ve yüksüz nötron); elektron bulutunda ise negatif yüklü elektron bulunmaktadır. Atomdaki proton sayısı elektron sayısına eşit olduğunda atom elektriksel olarak yüksüzdür. Elektron ve proton sayıları eşit değilse bu parçacık iyon olarak adlandırılır. İyonlar oldukça kararsız yapılardır ve yüksek enerjilerinden kurtulmak için ortamdaki başka iyon ve atomlarla etkileşime girerler.
Atom Numarası, Kütle Numarası ve İyon Yükü Kavramları
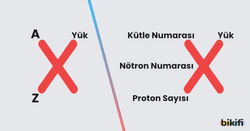
- Atom numarası: Bir atomda bulunan proton sayısı, elementi tanımlar ve atom numarası olarak adlandırılır. Atomda bulunan proton sayısı aynı zamanda, elementin kimyasal karakteri hakkında da bilgi verir. Atom numarası “Z” harfi ile gösterilir.
- Kütle Numarası: Atom çekirdeğindeki proton ve nötron sayılarının toplamına, o atomun kütle numarası denir. Kütle numarası “A” harfi ile gösterilir.
- İyon Yükü: Bir atomun elektron alması veya vermesi sonucu yüklenen yüktür. Atom elektron alırsa “-” yükle, elektron verirse “+” yükle yüklenir.”-” veya “+” yükle yüklenen atomlara iyon denir. “-” yüklü iyonlara anyon, “+” yüklü iyonlara katyon denir.
Aşağıda atom numarası, kütle numarası gibi kavramların atom altı parçacıklarla olan ilişkileri verilmiştir.
- Atom numarası = Çekirdek yükü = Proton sayısı
- Kütle numarası = Nükleon sayısı
- Kütle numarası = Proton sayısı + Nötron sayısı
- Nötr atom → Atom numarası = Proton sayısı = Elektron sayısı
- Yüklü tanecik → İyon yükü = Proton sayısı – Elektron sayısı
İzotop, İzoton, İzobar ve İzoelektronik Kavramları
- İzotop: Aynı proton sayısına fakat farklı kütle numarasına sahip atomlara izotop atomlar denir. İzotop atomlar uzay keşiflerinde büyük rol oynar. Kimyasal özellikleri hemen hemen aynı olduğu için periyodik cetvelde aynı yerde gösterilirler.
- Örneğin; hidrojen atomunun (1 proton ve 0 nötron); 1 proton ve 1 nötron ve 1 proton ve 2 nötrondan oluşan 2 tane izotop atomu vardır.
- İzoton: Yalnızca nötron sayıları aynı proton sayıları farklı olan taneciklere izoton tanecikler denir. İzoton taneciklerin proton sayıları farklı olduğu için taneciklerin kütle numarası da farklıdır.
- İzobar: Yalnızca kütle numaraları aynı olan fakat proton sayıları farklı olan atomlardır. Bunlar farklı elementlere ait olduklarından yalnızca kütle numaraları aynıdır, diğer tüm tanecik özellikleri farklıdır.
- İzoelektronik: Elektron dizilimleri ve sayıları aynı olan fakat proton sayısı farklı olan taneciklere izoelektronik tanecikler denir. İzoelektronik kavramında dikkat edilmesi gereken en önemli nokta elektron dizilimlerinin belli bir sayıdan sonra değişmesidir.
- Örneğin; N-3, F-1, Ne ve Na+1 taneciklerinde 10 tane elektron vardır ve hepsinin elektron dizilimleri aynıdır. Bu yüzden bu tanecikler izoelektronik taneciklerdir. Ancak 21Sc+2 (1s2 2s2 2p6 3s2 3p6 3d1) ve 19K (1s2 2s2 2p6 3s2 3p6 4s1) taneciklerinin elektron sayılarının aynı olmasına rağmen elektron dizilimleri farklıdır. Bu yüzden bu iki tanecik izoelektronik değildir.