Daha önce girişini yaptığımız periyodik özellikler konusunu bu yazıda daha detaylı bir şekilde işleyeceğiz. Bu linkten periyodik sistemin özelliklerine ve tarihçesine ulaşabilirsiniz.
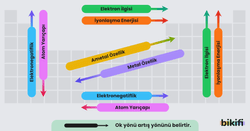
Periyodik cetvelin bilim insanlarına sağladığı en büyük fayda, bir elementin sadece periyodik cetvedeki yerini bilerek onun hakkında bazı bilgilere anında ulaşabilmektir. Periyodik cetvelin yapısı gereği bir takım özellikler periyodik olarak artar veya azalır. Bu özelliklere periyodik özellikler denir. Periyodik özelliklerin hemen hemen hepsi elektronların orbitallere dizilişine bağlı olarak açıklanabilir (ya da daha basit bir yorumla, atomun yarıçap büyüklüğüne bağlıdır).
Elektronegatiflik
Elektronegatiflik, bir molekül içindeki bir atomun elektronları çekme yeteneğinin bir ölçüsüdür. Genel olarak elektronegatiflik, periyotlarda soldan sağa doğru gidildikçe değerlik elektron sayısının artmasıyla artar. Gruplarda ise yukarıdan aşağı doğru inildikçe atom büyüklüğünün artmasıyla azalır. En elektronegatif atom flordur. Elektronegatiflik kavramını ortaya atan kişi Linus Pauling adlı Amerikalı kuantum kimyageridir. Paulingin listesine göre elektronegatiflik değerleri 0.7 ila 4 arasında değişmektedir. Bir elementin elektronegatifliği çok farklı şekillerde tanımlanabilir. Atom özelliklerine göre tanımını Robert Mulliken yapmıştır. Mulliken’e göre “Bir atom yüksek iyonlaşma enerjisi ve yüksek elektron ilgisine sahipse elektron kazanır.” Dolayısıyla yüksek elektronegatifli atom olarak ifade edilir. Bu gözlemler ve deneylerin sonucunda Mulliken bir elektronegatiflik tanımı ve eşitliği ortaya koymuştur.
EN=.K. [İE+Eİ]
- EN: Elektronegatiflik
- K: Sabit değer
- İE: İyonlaşma enerjisi
- Eİ: Elektron ilgisi
Eşiklikteki K sabit değeri keyfi olarak seçilmiştir. Flor elementi en elektronegatif element olarak kabul edilip değeri 4,0 seçilir.
Atom Yarıçapı
Bir periyotta soldan sağa doğru, çekirdek yükü ve çekirdeğin elektronları çekme gücü artar. Buna bağlı olarak atom çapı küçülür. Aynı grupta yukarıdan aşağıya doğru, atom numarası arttıkça enerji düzeyi (yörünge) sayısı da artar. Çekirdeğin elektronları çekme gücü azalır. Bundan dolayı atom çapı artar.
Yüksüz bir atom negatif yüklü iyon hâline geçerken elektron alır. Elektron sayısı proton sayısından fazla olduğundan çekirdeğin çekim gücü azalır ve hacmi büyür. Yüksüz bir atom pozitif yüklü iyon hâline geçerken elektron verir. Proton sayısı elektron sayısından fazla olduğundan çekirdeğin çekim gücü artar ve çapı küçülür.
Kovalent Yarıçapı
Ametal atomları kovalent bağlarla birbirlerine bağlanıp bağlı moleküller oluştururlar(Cl-Cl gibi ametal molekülleri arasında). Kovalent yarı çap, tek bir kovalent bağla bağlanmış eş değer iki atomun çekirdekleri arasındaki uzaklığın yarısıdır. Örneğin bir H2 molekülünün çekirdekleri arasındaki uzaklık 174 pm olduğundan klorun atom yarıçapı (kovalent yarıçap) 87 pm olur. (Uzaklıklar örneğin daha iyi anlaşılabilmesi için faraza olarak verilmiştir.)
Van der Walls Yarıçapı
Katı haldeki soy gazların, apolar molekülleri arasındaki hesaplanacak yarı çapa Van der Walls yarıçapı denir. Van der Walls kuvvetleri katı haldeki soy gazları bir arada tutan kuvvettir. Van der Walls yarı çapı ölçülen mesafenin yarısı kadardır.
İyonik Yarıçap
Metal atomu ile ametal atomlar arasında oluşan iyonik bileşiklerdeki katyonun veya anyonun yarıçapına “iyonik yarıçap” denir.
Metallik – Ametallik
Periyodik sistemdeki elementlerin büyük bir çoğunluğu metaldir. Bir periyotta soldan sağa doğru elementlerin elektron vermesi zorlaştığından elektron alma eğilimi artar yani ametalik özellik artar. Buna göre metaller genellikle periyodik sistemin solunda, ametaller ise sağında toplanmıştır.
Aynı grupta ise yukarıdan aşağıya doğru metalik özellik artarken ametalik özellik azalır. Bunun sebebi yukarıdan aşağıya doğru atom çapının artması ve en dış katmandaki elektronları çeken kuvvetin zayıflamasıdır, bu sayede en dış katmandaki elektronların koparılması kolaylaşır metalik özellik artar.
Elektron İlgisi
Gaz hâlindeki yüksüz (nötr) bir atomun bir elektron kazanarak negatif yüklü iyon hâline geçmesi sırasında açığa çıkan enerjiye elektron ilgisi denir. Elektron ilgisi de atomun büyüklüğü ile ilgilidir. Atom ne kadar küçükse elektrona çekirdek yükünün etkisi o kadar büyük olur. Bu durumda elektron ilgisi de artar. Elektron ilgisi periyodik cetvelde soldan sağa doğru genellikle artar, yukarıdan aşağıya doğru ise genellikle azalır. Aynı grupta yukarıdan aşağıya doğru elektron ilgisi genellikle azalır. Bu sebeple Cl atomunun elektron ilgisi F atomuna göre daha azdır.
İyonlaşma Enerjisi
Gaz hâlindeki nötr bir atomun en yüksek enerji düzeyinden bir elektron koparmak için atoma verilmesi gereken enerji miktarına iyonlaşma enerjisi denir. Gaz hâlindeki nötr bir atomdan bir elektron koparmak için atoma verilmesi gereken enerjiye birinci iyonlaşma enerjisi denir.
E1: Birinci iyonlaşma enerjisi (kj/mol)
Gaz hâlindeki +1 yüklü bir iyondan bir elektron koparmak için iyona verilmesi gereken enerjiye de ikinci iyonlaşma enerjisi denir.
E1: İkinci iyonlaşma enerjisi (kj/mol)
Aynı atomdan üçüncü, dördüncü elektronlar da koparılabilir. Bir atomun kaç tane elektronu varsa elektron sayısı kadar iyonlaşma enerjisinden söz edilebilir. Atom çapı küçüldükçe elektron koparmak güçleşir. İyonun yarıçapı küçüldükçe atom yarıçapı da küçülür dolayısı ile iyonlaşma enerjisi artar. Öyleyse bir atomun iyonlaşma enerjileri arasındaki ilişki her zaman …> E4 > E3 > E2 > E1 dir.
Periyodik cetvelde soldan sağa doğru çekirdek yükü artar. Değerlik elektronları çekirdek tarafından daha kuvvetli çekilir. Bundan dolayı elektronu koparmak güçleşir ve iyonlaşma enerjisi artar.
Aynı grupta yukarıdan aşağıya doğru atom çapı artar. Çekirdeğin elektronları çekim gücü azalır. Bu nedenle elektronu koparmak için az enerji gerekir. Böylece iyonlaşma enerjisi azalır.
| Birinci | İkinci | Üçüncü | Dördüncü | Beşinci | Altıncı | Yedinci | Sekizinci | |
| H | 1312 | |||||||
| He | 2371 | 5247 | ||||||
| Li | 520 | 7297 | 11810 | |||||
| Be | 900 | 1757 | 14840 | 21000 | ||||
| B | 800 | 2430 | 3659 | 25020 | 32810 | |||
| C | 1086 | 2352 | 4619 | 6221 | 37800 | 47300 | ||
| N | 1402 | 2857 | 4577 | 7473 | 9443 | 53250 | 64340 | |
| O | 1314 | 3391 | 5301 | 7468 | 10980 | 13320 | 71300 | 84050 |
| F | 1681 | 3375 | 6045 | 8418 | 11020 | 15160 | 17860 | 92000 |
| Ne | 2080 | 3963 | 6276 | 9376 | 12190 | 15230 | — | — |
| Na | 495,8 | 4565 | 6912 | 9540 | 13360 | 16610 | 20110 | 25490 |
| Mg | 737,6 | 1450 | 7732 | 10550 | 13620 | 18000 | 21700 | 25660 |
| Al | 577,4 | 1816 | 2744 | 11580 | 15030 | 18370 | 23290 | 27460 |
| Si | 786,2 | 1577 | 3229 | 4356 | 16080 | 19790 | 23780 | 29250 |
| P | 1012 | 1896 | 2910 | 4954 | 6272 | 21270 | 25410 | 29840 |
| S | 999,6 | 2260 | 3380 | 4565 | 6996 | 8490 | 28080 | 31720 |
| Cl | 1255 | 2297 | 3850 | 5146 | 6544 | 9330 | 11020 | 33600 |
| Ar | 1520 | 2665 | 3947 | 5770 | 7240 | 8810 | 11970 | 13840 |
| K | 418,8 | 3069 | 4600 | 5879 | 7971 | 9619 | 11380 | 14950 |
| Ca | 589,5 | 1146 | 4941 | 6485 | 8142 | 10520 | 12350 | 13830 |
Son olarak grup bakımından incelendiğinde iyonlaşma enerjilerini şu şekilde sıralayabiliriz.
1A<3A<2A<4A<6A<5A<7A<8A
✍ Konunun devamı:
Periyodik Sistem – S, P, D, F Blokları
Yükseltgenme Basamakları