Günlük hayatımızda veya evrenin herhangi bir yerinde ısı ve sıcaklığın olmadığı hiçbir olay yok denilebilir. Günlük hayatta birbiriyle ilişkili olan ısı ve sıcaklık kavramlarını sıkça kullanırız fakat sık sık bu kavramları birbirine karıştırırız.
İç Enerji, Sıcaklık ve Isı Kavramları
İç Enerji: Madde sahip olduğu moleküllerin titreşiminden dolayı kinetik enerjiye ve moleküller arası çekim kuvvetinden kaynaklı potansiyel enerjiye sahiptir. Maddenin sahip olduğu bu enerji türlerinin toplamına ise iş enerji denir. İç enerji U ile gösterilir ve birim olarak Joule, calori veya diğer enerji birimleri kullanılabilir.
Sıcaklık: Moleküllerin titreşme etkinliği yani kinetik enerji ile ilgili bir büyüklüktür. Bütün maddelerin molekülleri titreşir fakat bazılarında bu hareket fazla bazılarında azdır. Moleküllerin kinetik enerjisi ne kadar fazla ise maddenin sıcaklığı o kadar yüksektir.
Sıcaklık temel büyüklüklerden biridir. Bir maddenin sıcaklığı, maddenin cinsine ve miktarına bağlı değildir. Eşit sıcaklıkta farklı cins ve farklı kütlede bir çok madde bulunabilir.
Sıcaklık T ile gösterilir ve birimi SI’da Kelvin ‘dir. Günlük hayatta ise Celcius, Fahrenheit veya başka sistemler ile ölçeklenmiş sıcaklık ölçerler de kullanılabilir.
Isı: Sıcaklık değişimlerinde ve hal değiştirmelerde maddenin alabileceği veya verebileceği enerjiye denir. Sıcaklığı farklı iki madde yalıtılmış bir ortama konulduğunda sıcak maddeden soğuk olana enerji akışı olur. Enerji aktarımı sıcaklık eşitlenene kadar devam eder. Bu durumda aktarılan iç enerjiye ısı denir. Isı alan maddenin iç enerjisi artarken, veren maddenin iç enerjisi azalır.
Isı Q ile gösterilir ve birimi SI’da Joule, calori veya diğer enerji birimleridir. Kalorimetre kabu ile aktarılan ısı enerjisi hesaplanabilir.
Isı Sıcaklık Farkı
| Isı | Sıcaklık |
|---|---|
| Alınan ya da verilen bir enerji çeşididir. | Madde moleküllerinin ortalama kinetik enerjisin nicel görüntüsüdür. Enerji çeşidi değildir. |
| Kalorimetre kullanılarak ölçülür. | Kalorimetre ile ölçülür. |
| Termometre ile bulunan sonuç üzerinden yapılan hesaplama ile ölçülür. | Termometre ile doğrudan ölçülür. |
| Joule veya Calori | Kelvin veya celsius gibi sıcaklık birimleridir |
Calori (Kalori): 1 gram saf suyun sıcaklığını 1 derece yükseltmek için gerekli olan enerji miktarıdır. Mekanik sistemlerle ısının bağlantısını daha rahat kurabilmek için birim olarak Joule kullanmak daha doğru olacaktır. (1 cal = 4,18 j)
Termometre ve Sıcaklık Ölçümü
Sıcaklık ölçüm araçlarına termometre denir. Öşçülecek sıcaklık aralığına göre katı, sıvı ve gaz içeren termometreler kullanılır. Katı içerikli termometrelerde metalin uzunluğundaki değişim, sıvı içerikli termometrelerde sıvının hacmindeki değişim, gaz içeriklilerde ise gaz basıncındaki değişim gözlenmektedir.
Katı içerikli termometreler yüksek sıcaklıklar için kullanılırken sıvı içerikliler oda sıcaklığı civarı için ve gaz içerikliler ise çok düşük sıcaklıklar için kullanılır.
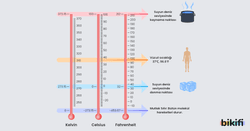
Sıcaklık değişimi için özel termometre yapılabilir. Örneğin içinde sıvı bulunan ince bir cam tüpteki sıvı seviyesinin sıcaklıkla değişimi sayesinde ölçüm yapılabilir. Suyun donma noktası olan 0 derecede termometrede bulunan sıvının bulunduğu noktaya bir çizgi koyup daha sonra suyun kaynama noktası olan 100 derecede de bir çizgi koyarsak. Bu iki çizgi arasını eşit aralıklara bölerek termometre elde edebiliriz. Bu aralığın 100 eşit parçaya bölünmüş hali Celcius ölçeğidir. Bu ölçekte sıfır noktası suyun donma noktasıdır ve daha düşük sıcaklıklar eksi (-) kabul edilir.
Kelvin (K) ölçeğinde ise sıfır noktası -273 derece’dir. Bu değer evrende ulaşılabilecek en düşük sıcaklıktır ve 0 K’dir.
0 K’den daha düşük sıcaklık olmadığından Kelvin ölçeği oranlı ölçek, Celcius ölçeği ise mutlak sıfırdan (0 K) başlamadığı için sıralı ölçektir.
Suyun üçlü noktası denen katı, sıvı, gaz halinin bir arada bulunduğu 1 atm basınçtaki sıcaklık 273,16 K = 0,01 °C olarak belirlenmiştir. Kelvin termometresinin dönüşüm değeri işlem kolaylığı olması için 273 olarak alınır.
Farklı termometrelerin 1 atm basınçta belirli sıcaklıklardaki karşılaştırması görselde verilmiştir.
Bu görseli formül haline getirecek olursak aşağıdaki gibi olur
ya da
Öz Isı ve Isı Sığası
Öz ısı: Saf bir maddenin 1 gramının sıcaklığını 1 °C değiştiren ısı miktarına denir. Maddeler için ayırt edici bir özelliktir ve ”c” ile gösterilir. SI birimi J/kg.K pratikte ise Cal/g.°C ‘dir.
Isı sığası: Maddenin sıcaklığını 1°C değiştiren ısı miktarına denir ve birimi cal/°C veya J/K ‘dır. Maddenin öz ısı ve kütle değerlerinin çarpımıdır (m.c).
Isı Alışverişi
Isı, sıcaklığı farklı olan maddeler arasında alınıp verilen enerji türüdür. Isı alışverişi olabilmesi için maddelerin sıcaklıklarının farklı olması gerekir. Sıcaklığı yüksek olan maddeden düşük olan maddeye ısı akışı olur.
Maddeye verilen ısı miktarının (Q), maddenin kütlesi (m), öz ısısı (c) ve sıcaklık değişimini (ΔT) aşağıdaki gibi modelleyebiliriz.
Hal Değişimi
Maddeler; katı, sıvı ve gaz olmak üzere, üç temel fiziksel halde bulunur. Maddeler ısı aldıklarında ya da verdiklerinde hal değişimi olabilir. Katının sıvı hale geçmesine erime, sıvıdan katı hale geçişe donma denir. Sıvının gaz hale geçmesine buharlaşma, gazın sıvı hale geçişine yoğuşma denir. Sıvının her sıcaklığında buharlaşma gerçekleşmektedir fakat sıcaklık artışı buharlaşmayı artırır, gözle görülebilir duruma ise kaynama denir.
- Saf maddelerin hepsi için belirli bir basınçta sabit erime-donma ve kaynama-yoğuşma sıcaklığı vardır ve maddenin ayırt edici özelliğidir.
- Saf maddelerin sıcaklığı, hal değişimi sırasında sabit kalır.
- Maddenin hal değişimi sırasında belirli bir basınçta 1 gramının değişimi için aldığı veya verdiği ısıya hal değişimi ısısı denir. L ile gösterilen bu değerin SI birimi J/kg dır (Cal/g olarak ta kullanılır). Madde için ayırt edici bir değerdir.
- Maddenin donarken verdiği donma ısısı ve erirken aldığı erime ısısı birbirine eşittir. .
- Maddenin yoğuşurken verdiği yoğuşma ısısı ve buharlaşırken aldığı buharlaşma ısısı birbirine eşittir. .
- Hal değişimi sırasında saf bir maddenin tamamının veya belirli bir kısmının hal değişimi için gereken ısı miktarı aşağıdaki gibi hesaplanır. Formülde Q ısı miktarı, m maddenin kütlesi ve L hal değişim ısısıdır.
Hal Değiştirme Isı Miktarı
Maddeler ısı alarak erir veya kaynarken ısı vererek donar veya yoğuşur. Bir maddenin erime ve donma sıcaklığı aynıyken buharlaşma ve yoğuşma sıcaklığı da birbirine eşittir.
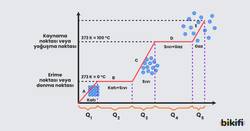
Aşağıda suyun hal değişimi ve sıcaklık değişim grafiği verilmiştir. Grafikten hareketle hal değişim ısıları ve ısınması için gereken ısı miktarı hesaplanabilir.
- Buzun sıcaklığının sıfıra doğru artması için gereken ısı miktarı
- Buzun erimesi için gereken ısı miktarı
- Suyun sıcaklık artışı için gereken ısı miktarı
- Suyun buharlaşması için gereken ısı miktarı
- Gazın sıcaklığının artması için gereken ısı miktarı
Isıl Denge
Sıcaklıkları farklı maddeler bir arada bulunduklarında sıcak maddeden soğuk olana enerji akışı olur ve bu akış iki maddenin de sıcaklıkları eşitlenene kadar devam eder. Sıcaklığın eşitlenerek enerji aktarımının durduğu bu duruma ısıl denge denir.
Isıl Dengenin Sıcaklık Farkı ve Isıyla Olan İlgisi
Maddeler ısıl dengeye ulaştıklarında verilen enerji miktarı ile alınan enerji miktarı sıfır olmalıdır.
Birinci maddenin sıcaklığına ikincinin sıcaklığına dersek ve olduğunu biliyorsak maddeler ısıl dengeye ulaştığında denge sıcaklığı() mutlaka şeklinde olur.
Eşitlik olmasının sebebi en az bir maddenin başlangıçta hal değişimi sıcaklığında olmasından kaynaklıdır. Örneğin buz hal değişim sıcaklığında (0°C) ise eriyecektir ve diğer maddenin sıcaklığını düşürürken hala 0°C de sabit kalabilir.
Enerji İletim Yolları ve İletim Hızı
Isı alan bir maddedeki moleküllerin ortalama hareketi artar. Hızlanan bu moleküller yanındaki moleküllere çarparak onlara enerjisini aktarır. Maddelerin bu şekilde enerjiyi aktarmasına ısı transferi denir.
Isının İletim Yolları
Maddeler ısıyı farklı yollarla iletmektedir ve bunları İletim, Konveksiyon (Taşıma), Işıma (Radyasyon) şeklinde 3 gruba ayırabiliriz.
İletim Yoluyla Isının İletimi
Isı alan bir katıdaki moleküllerin titreşim hızı artar ve bu moleküller yanındaki moleküllere çarparak onların da titreşim hızını artırır. Bu şekilde ısı enerjisi maddeye yayılır. İletim yoluyla ısı yayılırken moleküller yer değiştirmez.
Isı iletimi iyi olan maddeler(örneğin metaller) soğutma-ısıtma sistemlerinde yaygın olarak kullanılmaktadır. Isı iletkenliği az olan maddeler ise ısı yalıtım sistemlerinde kullanılmaktadır.
Pişen yemeğin içindeki metal kaşığın ısınması, yanan ateşe koyulan demir çubuğun ısınması bu yol ile gerçekleşir.
Konveksiyon (Taşıma) Yoluyla Isının İletimi
Isı alan sıvı ve gaz molekülleri soğuk moleküllerle çarpışır ve ısısının bir kısmını verir. Bu gerçekleşirken ısınan sıvı veya gazın özkütlesi genleşmeden dolayı düşeceği için madde akışı gerçekleşir. Isının bu şekilde yayılmasına konveksiyon yolu ile yayılma denir.
Kaynayan tenceredeki suyun yukarı doğru bir akım oluşturması, kalorifer radyatörünün ısıttığı havanın yukarı doğru hareket etmesi örnek olarak verilebilir. Yanan mumun üzerine tuttuğunuz elinizde hissettiğiniz sıcaklığın sebebi de budur.
Radyasyon (Işıma) Yoluyla Isının İletimi
Sıcak cisimlerden elektromanyetik dalga yayılması yoluyla enerji aktarımına ışıma denir. Isının görünür veya görünmez ışık ile yayılmasına radyasyon(ışıma) yolu ile iletim denir.
Güneşten ısının yayılması bu yolla olur. Işıma ile ısı yayılırken maddesel ortam şart değildir (örneğin uzay boşluğu). Yanan alevin yanına elinizi tuttuğunuzda hissettiğiniz ısının sebebi budur.
Katı Maddelerin Enerji İletim Hızı
Isı iletim hızı ya da enerji iletim hızı bir madde üzerinden birim zamanda aktarılan ısı miktarıdır. Aynı oda içinde ısıl dengede olan metal kapı kolu ve koltuğa dokunulduğunda koltuğun sıcaklığının kapı kolundan daha sıcak olduğu hissedilir. Bunun sebebi ısıyı metal kapı kolunun koltuğa göre daha hızlı iletmesidir. Metal kapı koluna dokunan elimizin ısısı koltuğa dokunan elimize oranla çok daha hızlı düştüğü için daha soğuk algılıyoruz. Isı iletkenliği ya da ısı iletim katsayısı maddenin ısıyı ne kadar iyi iletebildiğini gösteren bir özelliktir. Isı iletim hızını etkiler.
Isı iletim hızı matematiksel olarak aşağıdaki gibi modellenebilir.
- A: İletim doğrultusuna dik kesit alanı ()
- ΔT: Ortamlar arası sıcaklık farkı (K)
- Δt: Süre (s)
- L: İletim doğrultusundaki mesafe (m)
- ΔQ: Aktarılan ısı enerjisi miktarı (J)
- k: Maddenin ısı iletim katsayısı (W/m.K)
Hissedilen ve gerçek sıcaklık ile ilgili şu yazıya bakabilirsiniz: Bağıl Nem ve Hissedilen Sıcaklık İlişkisi
Genleşme
Isı alan ve veren maddelerin boyutlarında değişim olur. Madde hal değiştirmiyorsa, ısı aldığında boyutu büyürken ısı verdiğinde boyutu küçülür.
Isı alan maddenin boyutunun büyümesine genleşme ısı veren maddenin boyutlarının küçülmesine büzülme denir. Genleşme ve büzülme olayları birbirinin tersidir ve madde sıcaklık aldığında ne kadar genleşiyorsa aynı sıcaklığı verdiğinde o kadar büzülür.
Katı ve Sıvılarda Genleşme ve Büzülme
Sıcaklığı artan maddelerin genellikle uzunluğu, yüzey alanı ve hacmi artar.
- Tel gibi ince uzun cisimlerde uzunluk değişimi önemsenir. ΔL telin metre türünden uzunluk değişimi, ilk uzunluk (m), λ uzunluk değişim katsayısı(1/K), ΔT sıcaklık değişimi(T) ise ΔL aşağıdaki gibi hesaplanır.
- Levha türü cisimlerde yüzey değişimi önemsenir. ΔA yüzey değişimi(), ilk yüzey(), 2λ yüzey değişim katsayısı(1/K), ΔT sıcaklık değişimi(T) ise ΔA aşağıdaki gibi hesaplanır.
- Prizma gibi üç boyutu da birbirine yaklaşık olan cisimlerde ise uzunluk ve yüzey değişimi ile birlikte hacim değişimi de dikkate alınır. ΔV hacim değişimi(), ilk hacim, 3λ hacim değişim katsayısı(1/K), ΔT sıcaklık değişimi(T) ise ΔV hacim değişimi aşağıdaki gibi hesaplanır.
Sıvıların genleşmesi yalnız hacim değişimi şeklinde gözlemlenir, genleşmesi önemsiz kaplarda genleşen sıvı kabın içinde yükselir.
Maddelerin boyut değişim miktarı başlangıçtaki uzunluk, yüzey ve hacminin büyüklüğüne, sıcaklık değişiminin büyüklüğüne ve maddeye has değişim katsayısına bağlıdır.