Gaz moleküllerinin davranışı katı ve sıvı moleküllerinin davranışından farklıdır. Bu davranış farklılığı bilim insanları tarafından kinetik teori ile ifade edilmeye çalışılmıştır. Kinetik teori Daniel Bernoulli tarafından öne sürülmüştür.
Kinetik teori; gazların makroskopik özelliklerini gaz taneciklerinin hareketleriyle açıklamaya çalışır. Gazların içinde bulundukları kabın çeperine yaptığı basıncı, gaz taneciklerinin bu çepere çarpması sonucu oluştuğunu kabul eder.
Kinetik Teoriye göre;
- Gazlar birbirlerine göre oldukça uzakta bulunan, her yöne doğru hızlı, sürekli, zikzaklı ve doğrusal olarak hareket eden moleküllerden (taneciklerden) oluşmuştur.
- Gaz tanecikleri birbirleri arasında ve bulundukları kap ile esnek çarpışma yapar. Yani taneciklerin enerjileri değişse bile toplam iç enerji korunur.
- Gaz tanecikleri elektron ile proton arasındaki davranışın aksine birbirlerine itme veya çekme kuvveti uygulamaz.
- Gazların hacimleri ihmal edilirken kütleleri varmış gibi düşünülebilir.
- Gaz taneciklerinin mutlak sıcaklıkları, ortalama kinetik enerjileriyle doğru orantılı olarak değişir.
- Gaz taneciklerinin ortalama kinetik enerjileri sadece mutlak sıcaklık ile değişiklik gösterir
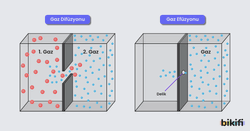
Graham Difüzyon Yasası
Gazlar hareketli taneciklere sahip oldukları için birbirleri içine karışabilir (difüzyon) veya küçük bir delik aracılığıyla daha düşük basınçlı ortama yayılabilir (efüzyon – dışa yayılma).
Gazların kinetik enerjilerine göre difüzyon ve efüzyon hızı değişir. Aşağıda kinetik enerjinin sıcaklıkla bağlantılı formülü gösterilmiştir.
Formülde bulunan “k” Boltzmann sabitidir. Formüle baktığımızda değişken olarak sadece mutlak sıcaklık olduğu için sıcaklığın artması veya azalması kinetik enerjide de aynı etkiyi gösterecektir. Yine mutlak sıcaklık sayesinde aynı ortamda bulunan gaz taneciklerinin ortalama kinetik enerjilerinin aynı olduğu sonucunu çıkarabiliriz. Şimdi ise kinetik enerji ve hız arasındaki ilişkiyi inceleyelim.
İki formülü beraber incelediğimizde mutlak sıcaklık arttığında kinetik enerjinin arttığını, kinetik enerji arttığında da molekül kütlesine bağlı olarak hızlarının artığını görürüz. Gaz tanelerinin hızları artıyorsa difüzyon ve efüzyon hızları da artacaktır.
Aynı sıcaklığa sahip iki farklı gaz molekülünün difüzyon ve efüzyon hızları, hız içeren kinetik enerji formülü kullanılarak karşılaştırılabilir.
- : X molekülünün ortalama kinetik enerjisi
- : Y molekülünün ortalama kinetik enerjisi
- : X gazı tanecik kütlesi
- : Y gazı tanecik kütlesi
- : X gazının ortalama yayılma hızı
- : Y gazının ortalama yayılma hızı
- (Sıcaklıkları eşit olduğu için ortalama kinetik enerjileri eşittir)
- (Gazların tanecik kütlesi yerine mol kütleleri alındığında)
Bu son bulduğumuz formülde görüldüğü gibi gaz taneciklerinin ortalama hızları ile molekül kütleleri arasındaki bağıntıya Graham Difüzyon Yasası denir. Graham Difüzyon Yasasına göre gaz molekülünün difüzyon veya efüzyon hızları mol kütlelerinin kareköküyle ters orantılıdır.
Kinetik enerjinin iki farklı formülünü birbirine eşitleyerek birleştirebiliriz. Buradan gaz moleküllerinin hızının mutlak sıcaklık ve molekül kütleleri ile ilişkileri görülebilir.
Bu eşitlikte ortalama hızı yalnız bırakırız.
Artık bu formülle farklı sıcaklıktaki iki farklı gaz molekülünün difüzyon ve efüzyon hızları karşılaştırılabilir.
Farklı sıcaklıktaki iki farklı gaz molekülünün difüzyon ve efüzyon hızları karşılaştırıldığında sıcaklığın kareköküyle doğru, mol kütlesinin kareköküyle ters orantılı olduğunu gördük.
Gazların yayılma hızı ile yayılma süreleri ters orantılıdır yani yayılma hızı arttıkça yayılma süresi azalacaktır. Bu mol kütlesi küçük olan gaz için daha hızlı ve daha kısa sürede yayılacağı anlamına gelir. Graham Difüzyon Yasasındaki denkleme yayılma süresini de ekleyerek her veriyi tek eşitlikte görebiliriz.
- : X gazının yayılma süresi
- : Y gazının yayılma süresi